|
Siguiente |

|
Anterior |
|
Electricidad por reacción química
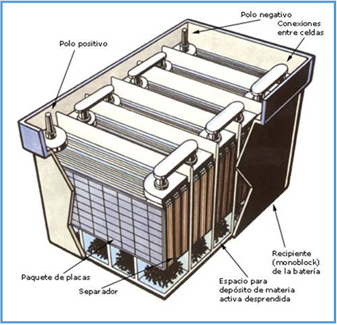
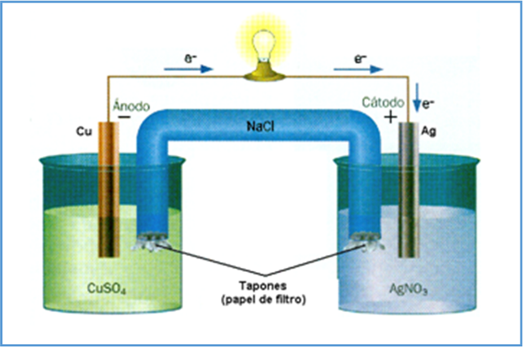
Una de las formas más eficientes y ampliamente utilizadas para generar electricidad, es la de las reacciones químicas. Como ejemplo, tenemos las pilas y baterías utilizadas en equipos portátiles, radios, automóviles, etc.; se puede decir que una pila es un medio que transforma la energía química en eléctrica, ya que está formada por un electrolito (que puede ser líquido, sólido o de pasta), un electrodo positivo y un electrodo negativo. El electrolito, una sustancia química, reacciona con los electrodos, de tal forma que a uno de ellos llegan los electrones liberados por la reacción -haciéndose negativo-, mientras que el otro, habiéndolos perdido, adquiere carga positiva. |
|
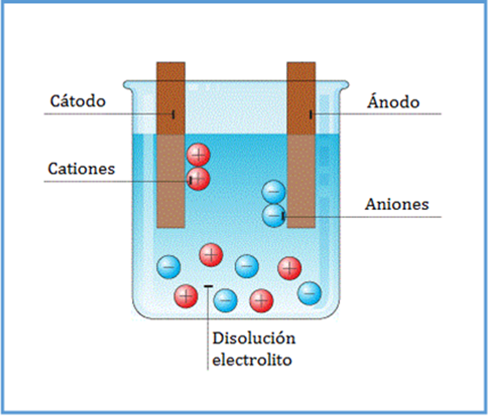
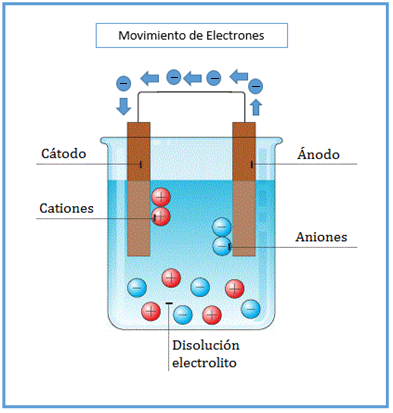
Esta diferencia de cargas entre los dos electrodos se conoce como “diferencia de potencial”. Si se conecta un cable conductor externo que los comunique, la diferencia de potencial origina un camino por el que los electrones del electrodo negativo pasan al electrodo positivo. Precisamente, al desplazamiento de los electrones a través de un conductor se le conoce con el nombre de “corriente eléctrica”. |
|
Básicamente, podemos hablar de dos tipos de pilas: primarias y secundarias.
En el caso de las primarias, la sustancia química utilizada se transforma lentamente en sustancias diferentes; y es que, a causa de la reacción química que libera los electrones, el electrolito no puede transformarse en la sustancia original que era antes de suceder aquélla (es cuando se dice que “las pilas se han descargado”). Las pilas de este tipo también reciben el nombre “voltaicas”. |

|
Por su parte, las pilas secundarias, baterías o acumuladores, tienen la característica de que en ellas el electrolito sí puede ser reconvertido después de utilizarse en las sustancias originales; para lograrlo, basta con pasar a través de él una corriente eléctrica, pero en sentido contrario al de su operación normal (esto es a lo que se llama “recarga de la pila”). |